Las tecnologías de identificación única de dispositivos automatizan la lectura de códigos de barras e identificaciones médicas
Colaboración de Editores de DigiKey de América del Norte
2023-10-26
En 2013, la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) puso en marcha el Sistema de Identificación Única de Dispositivos o norma UDI. La norma pretendía mejorar la seguridad de los pacientes proporcionando un método coherente de seguimiento e identificación de los productos sanitarios mediante el uso de documentación moderna en los puntos de fabricación, distribución y uso. Al igual que los requisitos de la normativa sobre productos sanitarios en Europa o normativas similares en otros países, la norma estadounidense sobre UDI aumenta la precisión de los informes y facilita el análisis en caso de retirada del mercado o acontecimiento adverso.
A partir del 24 de septiembre de 2023, la FDA aplicará plenamente el Código Nacional de Artículos Relacionados con la Salud y los Números de Código de Medicamentos en las etiquetas y envases de los dispositivos. Todos los productos de uso médico etiquetados a partir de esa fecha deben cumplir plenamente los mandatos de UDI. Este mandato impactará en lo siguiente:
- Productos vitales de clase 3, como marcapasos y prótesis implantadas
- Productos de clase 2 moderadamente críticos, como jeringuillas, catéteres y suturas absorbibles
- Productos de la clase 1 de menor riesgo, como el hilo dental, las batas médicas y las máscaras de oxígeno.
La plena aplicación del mandato significa que si un producto sanitario no tiene un código de barras escaneable, dejará de considerarse un producto válido/utilizable, aunque lleve etiquetas legibles por el ser humano y aunque se suponga en general que el producto es fácilmente identificable por la mayoría de los usuarios. Esta plena aplicación estimulará la adopción generalizada por parte de la industria médica y la facturación de los seguros médicos.
 Figura 1: Algunos verificadores portátiles de códigos de barras de marcas directas de pieza (DPM) incorporan iluminación avanzada y otros programas informáticos para encontrar automáticamente los símbolos y pasar por los ajustes para optimizar la lectura de la marca DPM específica y el sustrato de material de que se trate. De hecho, el LVS-9585 que se muestra aquí puede verificar tanto piezas DPM como etiquetas impresas para realizar análisis e informes exhaustivos. (Fuente de la imagen: Omron Automation)
Figura 1: Algunos verificadores portátiles de códigos de barras de marcas directas de pieza (DPM) incorporan iluminación avanzada y otros programas informáticos para encontrar automáticamente los símbolos y pasar por los ajustes para optimizar la lectura de la marca DPM específica y el sustrato de material de que se trate. De hecho, el LVS-9585 que se muestra aquí puede verificar tanto piezas DPM como etiquetas impresas para realizar análisis e informes exhaustivos. (Fuente de la imagen: Omron Automation)
La entidad contratante (portadora de la marca) es responsable.
En EE. UU., el titular de la propiedad intelectual y la marca de cara al usuario de cada producto médico es responsable de la exactitud y calidad de los códigos UDI. Esto es especialmente importante porque gran parte del mercado de productos médicos se fabrica por contrato y se subcontrata a otras organizaciones. Por lo tanto, es responsabilidad de la organización contratante asegurarse de que toda su cadena de suministro cumple las normas UDI y produce etiquetas precisas.
Origen de la tecnología de identificación única de dispositivos
Los UDI son identificadores estáticos de dispositivos. Sin embargo, los cambios en la cantidad de artículos de un paquete pueden provocar la necesidad de un nuevo identificador. Los organismos emisores dictan cómo se distinguen estos detalles. Del mismo modo, la modificación de las condiciones de esterilidad del embalaje de un producto puede modificar también el identificador del producto. El cambio del mercado de destino de un producto (el país en el que se venderá), del idioma de la etiqueta o del motor de cómputo (CE) también puede requerir cambios en el identificador del producto.
Antes de la norma UDI, un fabricante de dispositivos médicos podía etiquetar un producto con un número de pieza concreto. El distribuidor cambiaría ese número de pieza antes de que el proveedor de asistencia sanitaria o el hospital volvieran a cambiarlo. Con la posibilidad de que cada entidad cambiara el número de pieza antes de llegar al paciente, era casi imposible hacer un seguimiento de los productos, gestionar las retiradas, evitar las falsificaciones o hacer pedidos precisos de nuevas existencias con eficacia.
Relacionados: Implantación de soluciones sólidas de trazabilidad
En la actualidad, se asigna a cada dispositivo un identificador normalizado y persistente, denominado UDI, para permitir a todas las entidades una identificación más rápida y precisa del dispositivo, reduciendo en última instancia los errores médicos. Este UDI es un código alfanumérico que contiene dos datos clave:
- Un identificador de dispositivo
- Un identificador de producción
Un identificador de dispositivo es una etiqueta estática asignada a un dispositivo determinado en la que figura el etiquetador (normalmente el fabricante del dispositivo) y el número de modelo específico del dispositivo. En cambio, un identificador de producción contiene datos que pueden variar, y muchos de los datos que puede contener son opcionales. Pueden incluir códigos de lote, números de serie, fechas de caducidad y fechas de fabricación. En resumen, los datos opcionales podrían ser cualquier cosa que un fabricante o etiquetador considere necesaria para apoyar el seguimiento del dispositivo.
Cada etiqueta UDI debe presentar esta información de dos formas:
- Formato legible (texto sin formato)
- Forma legible por máquina (por código de barras o lector RFID)
Siempre que un producto pueda satisfacer múltiples aplicaciones médicas, el UDI debe marcarse directamente en el producto, no en su embalaje. La norma también se aplica a los dispositivos que pueden utilizarse varias veces.
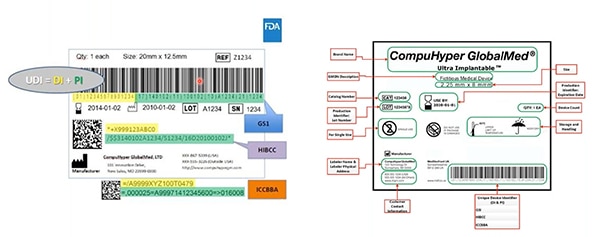 Figura 2: GS1, HIBCC e ICCBBA -organismos emisores de UDI- crean los UDI; asignan a los UDI la simbología permitida; definen qué tecnologías pueden interactuar con los UDI; y especifican la calidad requerida de las marcas UDI. En esta muestra, el identificador del dispositivo aparece resaltado en amarillo; en verde, los identificadores de producción. Otros elementos son la información legible por el ser humano... y que también está codificada en el código de barras legible por máquina. (Fuente de la imagen: FDA)
Figura 2: GS1, HIBCC e ICCBBA -organismos emisores de UDI- crean los UDI; asignan a los UDI la simbología permitida; definen qué tecnologías pueden interactuar con los UDI; y especifican la calidad requerida de las marcas UDI. En esta muestra, el identificador del dispositivo aparece resaltado en amarillo; en verde, los identificadores de producción. Otros elementos son la información legible por el ser humano... y que también está codificada en el código de barras legible por máquina. (Fuente de la imagen: FDA)
Todos los productos deben registrarse en la base de datos mundial de UDI para permitir su seguimiento en caso de retirada del mercado y dar acceso al público a la información sobre un producto determinado. Las agencias emisoras acreditadas por la FDA están autorizadas a crear identificadores únicos para que los fabricantes de dispositivos los coloquen en sus productos.
Documentación técnica relacionada: Mantenerse al día en materia de trazabilidad
Tecnologías y técnicas de escaneado de UDI
Las etiquetas UDI pueden verificarse de varias formas a lo largo de su trayecto desde la fabricación hasta el uso.
La verificación en línea se realiza mediante tecnologías integradas en maquinaria de mayor tamaño para el procesamiento rápido y preciso de grandes cantidades de producto a medida que se fabrica. Apoyadas por un software avanzado, estas tecnologías adoptan a veces la forma de impresoras de etiquetas industriales. Estas impresoras son capaces de realizar su propia verificación en línea para confirmar que la información UDI es legible de acuerdo con las exigentes normas del sector inmediatamente después de su creación en el punto de producción de etiquetas. Por ejemplo, los verificadores V275 de Omron Automation se utilizan con impresoras térmicas Zebra para cumplir la norma ISO 15426 y las normas GS1 de la autoridad emisora para la conformidad con la FDA.
Relacionados: Soluciones de trazabilidad de Omron
En otros lugares, la verificación en línea adopta la forma de visión artificial especializada que flanquea cintas transportadoras en líneas de producción automatizadas, incorporando la lectura de códigos de barras para una verificación extremadamente rápida y precisa del etiquetado UDI en productos de alta mezcla en líneas de producción de alta velocidad. Las ofertas MicroHAWK de Omron Automation sobresalen en esta área con sensores avanzados complementados por una construcción miniaturizada y opciones de conectividad que incluyen Ethernet/IP y PROFINET.
Relacionado: Evite la responsabilidad del etiquetado incorrecto
En cambio, la verificación UDI fuera de línea es la más adecuada para el muestreo de lotes de etiquetas con el fin de garantizar la calidad. La verificación fuera de línea, empleada a menudo para la comprobación de muestras cuando los productos sanitarios salen o llegan a un centro, puede complementar los sistemas de verificación en línea en las fases previas del proceso de distribución.
 Figura 3: Los UDI marcados directamente en los productos requieren verificadores diferentes de los utilizados para los UDI impresos en etiquetas adheridas. (Fuente de la imagen: Omron Automation)
Figura 3: Los UDI marcados directamente en los productos requieren verificadores diferentes de los utilizados para los UDI impresos en etiquetas adheridas. (Fuente de la imagen: Omron Automation)
De hecho, todas las operaciones de distribución médica y asistencia sanitaria pueden beneficiarse del uso de verificadores que cumplan la norma ISO. Considere los productos de verificación UDI fuera de línea de la serie LVS 95XX de Omron. Estos son empleados:
- En estaciones de marcado láser e impresoras de etiquetas donde se crean códigos
- Cuando los códigos se aplican a productos, que pueden o no estar separados del área de creación de códigos.
- En las estaciones de control de calidad, donde se confirman las plantillas, el formato y otros elementos del código.
Especificación de las variaciones del verificador UDI fuera de línea
El verificador UDI fuera de línea más adecuado para una aplicación determinada depende de varios parámetros.
Tamaño de los códigos de barras: Los códigos de barras grandes suelen ser más fáciles de escanear con identificadores que tienen un gran campo de visión definido por la distancia focal del objetivo y el tamaño del sensor. Considere los identificadores UDI de sobremesa LVS-9510 de Omron Automation. Esta serie de producto puede leer tanto etiquetas lineales como 2D. Cinco versiones diferentes, cada una con un campo de visión distinto, para que los diseñadores puedan seleccionar la versión compatible con el tamaño del código de barras que debe verificarse. Una función de cosido permite clasificar los códigos de barras que superan el campo de visión.
Además, todos los LVS-9510 pueden determinar automáticamente la simbología y la apertura necesarias para evaluar el código e identificar y resaltar los puntos problemáticos.
 Figura 4: La verificación de códigos de barras que cumplen las normas ISO es más fácil con equipos que pueden verificar tanto códigos lineales (1D) como bidimensionales (2D). Algunos de estos equipos determinan la simbología y la apertura necesarias para evaluar los códigos e identifican y resaltan los problemas. El LVS-9510 que se muestra aquí tiene una función de cosido que permite la clasificación de códigos de barras más grandes que el campo de visión. (Fuente de la imagen: Omron Automation)
Figura 4: La verificación de códigos de barras que cumplen las normas ISO es más fácil con equipos que pueden verificar tanto códigos lineales (1D) como bidimensionales (2D). Algunos de estos equipos determinan la simbología y la apertura necesarias para evaluar los códigos e identifican y resaltan los problemas. El LVS-9510 que se muestra aquí tiene una función de cosido que permite la clasificación de códigos de barras más grandes que el campo de visión. (Fuente de la imagen: Omron Automation)
Tipo de código de barras: Los escáneres deben leer los formatos de códigos de barras asignados por los organismos emisores conocidos como HIBCC, ICCBBA o (el más común a partir de 2023) GS1. GS1 dicta el tamaño, el formato y la resolución de los códigos UPC, los códigos de barras lineales y los códigos de barras de matriz de datos 2D.
Ubicación de la marca UDI: Considere el marcado directo de piezas (DPM) de los productos sanitarios. Estas marcas pueden ser increíblemente diminutas, sobre todo cuando identifican instrumentos quirúrgicos y dispositivos médicos implantables. Para leer y verificar tales DPM UDI, los verificadores portátiles de ultra alta densidad LVS-9580 y LVS-9585 de Omron incorporan una lente especializada que puede clasificar una miríada de DPM, incluidos aquellos con tamaños de celda de hasta 0.002 pulg. Las lentes de calidad industrial del interior de los LVS-9580 y LVS-9585 garantizan una precisión de lectura constante. Las más sofisticadas son las tecnologías de iluminación altamente controlables y calibrables dentro de los escáneres. Junto con los múltiples campos de visión, la iluminación permite la optimización inmediata de las imágenes UDI capturadas. Esto es especialmente importante, ya que el código estándar no permite correcciones a posteriori ni manipulaciones de la imagen.
Más información sobre el software de escáner UDI
Para lograr la máxima eficacia, el software UDI de apoyo al hardware verificador debe presentar la información de diagnóstico en un formato intuitivo. Este software debe calificar los códigos UDI de acuerdo con los parámetros definidos por la ISO (sobre todo para confirmar su legibilidad) y, en el mejor de los casos, también debe realizar un seguimiento de los problemas de empeoramiento a lo largo de una serie de escaneados de UDI.
Omron incluye todo el software necesario con cada uno de sus equipos de escaneado UDI. El software se actualiza periódicamente para seguir el ritmo de la rápida evolución de la normativa y la nueva legislación del sector.
Una de las principales funciones del software para escáneres Omron es la gestión de la sintaxis de los códigos. En resumen, cada código de barras o código 2D debe extraer con precisión toda la información pertinente, incluido el tipo de producto, el número de lote, la cantidad si procede, la fecha de caducidad, la información de envío, etc. Las cadenas de datos resultantes deben formatearse de una manera determinada para adaptarse a la evolución de los requisitos, las metodologías y los destinos de los productos médicos.
La actualización periódica del software por parte del fabricante del escáner garantiza que los usuarios finales se mantengan al día incluso cuando se publiquen nuevos códigos.
Conclusión:
En su día, el ejército estadounidense se propuso implantar un sistema de seguimiento de productos mediante identificación única, como el sistema de identificación única de la industria médica. Su objetivo era reducir el despilfarro masivo de suministros perdidos, duplicados y no contabilizados en las instalaciones militares, desde armamento Raytheon terminado hasta placas de control suministradas por una pequeña empresa para una aplicación especializada. En la actualidad, los UID se utilizan en distintos grados.
No ocurrirá lo mismo con el mandato de UDI.
El mantra que impulsa la adopción de la identificación única es sencillo: La etiqueta es el producto. Al fin y al cabo, una etiqueta incorrecta puede provocar una cadena de acontecimientos que haga perder tiempo al personal médico y acabe con el producto sanitario desechado. Por lo tanto, los UDI deben aparecer en todas las capas del envase, como a nivel de unidad, paquete, bulto, caja y palé. Los UDI en productos sanitarios estériles dentro de precintos de esterilización son especialmente importantes, ya que romper el precinto para verificar el tipo de producto es inaceptable.
Con la FDA exigiendo la plena adhesión a las directivas UDI a partir del 24 de septiembre de 2023, las tecnologías de escaneado avanzadas para verificar los productos médicos se convertirán en primordiales para los fabricantes de automatización, así como para los fabricantes de máquinas y los usuarios finales a los que sirven.
Estos escáneres pueden satisfacer requisitos UDI extremadamente específicos de la FDA para confirmar etiquetas en una amplia matriz de equipos de laboratorio, uso médico y diagnóstico clínico. Verificadores de códigos de barras fuera de línea Maximice la trazabilidad, la visión artificial en línea y los lectores DPM avanzados.

Descargo de responsabilidad: Las opiniones, creencias y puntos de vista expresados por los autores o participantes del foro de este sitio web no reflejan necesariamente las opiniones, las creencias y los puntos de vista de DigiKey o de las políticas oficiales de DigiKey.









